- · 心血管病学进展版面费是[06/30]
- · 《心血管病学进展》投稿[06/30]
- · 《心血管病学进展》期刊[06/30]
张运院士团队心血管基础研究取得系列新成果(2)
作者:网站采编关键词:
摘要:动脉粥样硬化性心血管疾病已成为我国人口死亡的首要病因。大量基础和临床研究证明,动脉粥样硬化(AS)是一种慢性炎症性疾病,2017年发表的CANTOS临床
动脉粥样硬化性心血管疾病已成为我国人口死亡的首要病因。大量基础和临床研究证明,动脉粥样硬化(AS)是一种慢性炎症性疾病,2017年发表的CANTOS临床试验将IL-1β确立为AS抗炎治疗的关键靶点,使用IL-1β的单克隆抗体治疗心肌梗死后患者取得了成功。NLRP3炎性小体是IL-1β的上游调控节点,NLRP3炎性小体活化可促进 IL-1β的产生,在AS炎症反应中起关键作用。NLRP3炎性小体的降解可负性调控NLRP3炎性小体的活化,深入探讨 NLRP3炎性小体的负性调控机制,对于降低 IL-1β水平和干预AS的发生和发展具有重要意义。分 子 伴 侣 介 导 的 自 噬 (CMA)可针对性地介导细胞代谢过程中的一些关键蛋白质的降解,因而是一种特异和高效的蛋白质降解系统,但CMA能否调控NLRP3炎性小体的降解并在AS进程中发挥作用尚不明了。张运院士领导的课题组在ApoE-/-小鼠中建立了不同病程的AS模型,发现随着AS斑块的不断进展,CMA的标志物LAMP-2A表达量逐渐减少,在人体尸检标本中观察到同样的现象。课题组构建了巨噬细胞 LAMP-2A基因特异性敲除小鼠以阻断CMA的功能,结果显示,与同窝CMA功能正常且病程相同的小鼠相比,CMA缺陷小鼠的主动脉弓及分支处斑块数量明显增多,主动脉根部的斑块面积明显增大,表明CMA缺陷可促进AS斑块的进展。体外实验证明,巨噬细胞CMA缺失可导致NLRP3炎性小体的激活,进而活化半胱天冬酶 1,后者切割IL-1β和IL-18并使其活化,反之,将LAMP-2A转入CMA缺失的巨噬细胞可明显逆转NLRP3炎性小体的活化程度。课题组在体外和体内实验进一步证实,NLRP3蛋白是通过CMA途径降解的,CMA缺陷导致NLRP3蛋白降解受阻,这是CMA调控NLRP3炎性小体活化的重要机制。该研究首次发现了CMA在AS发病机制中的作用,证明巨噬细胞CMA功能缺陷可增强 NLRP3炎性小体所介导的炎症反应,从而加速AS进展,上调CMA功能有望成为治疗AS、肥胖、代谢紊乱综合征等慢性炎症性疾病的新途径。
该研究发表于Nature子刊《细胞死亡和分化》(Cell Death and Differentiation,中科院一区,IF:15.828),论文的第一作者是山东大学齐鲁医院心内科博士后张杰,山东大学齐鲁医院张猛教授、张运院士和山东大学基础医学院高成江教授为该论文的共同通讯作者。山东大学齐鲁医院为第一和通讯作者单位。
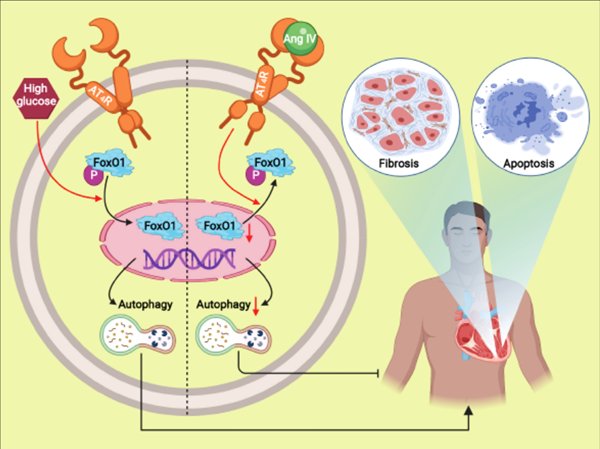
该研究发表于国际权威期刊《治疗诊断学》(Theranostics,中科院一区,最新IF 11.556),论文的第一作者是山东大学齐鲁医院心内科章萌医师,山东大学齐鲁医院心内科张运院士、张澄教授和郝盼盼教授为该论文的共同通讯作者。
该研究发表于美国心脏学会主办的心血管基础研究领域的国际顶尖杂志《循环研究》(Circulation Research,中科院一区,最新影响因子17.367),论文的第一作者是山东大学齐鲁医院心内科博士后乔磊和博士生马静,山东大学齐鲁医院张运院士和陈文强教授为该论文的共同通讯作者。山东大学齐鲁医院为第一和通讯作者单位。
文章链接:
文章来源:《心血管病学进展》 网址: http://www.xxgbxjzzzs.cn/zonghexinwen/2022/0708/560.html